Résumé
La neurohypophyse est une interface neuro-vasculaire à travers laquelle le cerveau régule plusieurs organes périphériques en vue de maintenir l’homéostasie. La mise au point de nouveaux outils génétiques ou d’imagerie a commencé à ouvrir de nouvelles perspectives concernant les mécanismes moléculaires qui sous-tendent sa formation. Dans un travail récent, des chercheurs ont découvert que chez l’embryon de poisson-zèbre, l’ocytocine libérée par les axones hypophysaires sert de signal angiogénique local qui attire les vaisseaux sanguins à proximité.
Le système hypothalamo-neurohypophysaire (SNH) est constitué de corps cellulaires neuronaux situés dans les noyaux supraoptiques et paraventriculaires de l’hypothalamus. Ces neurones produisent les peptides ocytocine et vasopressine. Ceux-ci sont empaquetés dans des vésicules ensuite transportées dans des axones qui se terminent dans la neurohypophyse. En réponse à la stimulation, les vésicules libèrent leur contenu dans une matrice de capillaires fenêtrés (c’est-à-dire perméables) par lesquels ils entrent dans le sang pour exercer leurs effets bien connus sur la balance hydrique et sur la reproduction.
« Un rendez-vous »
Plus d’un siècle de recherches ont élucidé la structure fine de la neurohypophyse. C’est essentiellement une interface entre deux éléments biologiques distincts : les axones de neurones centraux et des vaisseaux périphériques. Une troisième composante, les pituicytes, facilite cette fonction d’interface. Chacun des trois éléments du système dérive d’une lignée cellulaire distincte pendant le développement embryonnaire mais d’une façon ou d’une autre ils atteignent le même point et interagissent entre eux pour former la neurohypophyse. Les événements cellulaires qui sous-tendent précisément ce processus sont restés largement inconnus parce que la dynamique du développement de cette structure complexe en trois dimensions ne peut pas être directement déduite de coupes histologiques de tissu fixé. Cette limitation a été récemment surmontée par l’utilisation d’imagerie in vivo et des outils de génétique moléculaire et par l’instauration du poisson zèbre comme modèle pour l’étude du développement du cerveau des vertébrés.
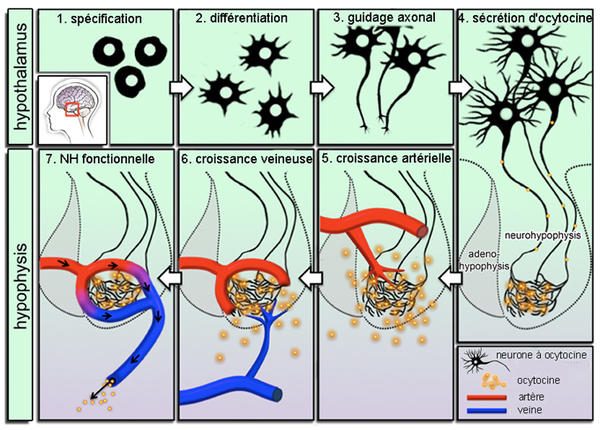
Dans l’hypothalamus, des précurseurs neuronaux répondent à des signaux internes et externes qui les spécifient (1). Ils se différencient en neurones à ocytocine (2) et leurs axones s’étendent jusqu’à la neurohypophyse(3). L’ocytocine est produite dans les corps cellulaires, exportée jusqu’aux terminaisons axonales et sécrétée dans la neurohypophyse (4). L’ocytocine agit comme un facteur angiogénique, attirant des bourgeons vasculaires issues des artères (5) puis des veines (6) voisines. Quand la vascularisation hypophysaire s’est mise en place, le flux sanguin traverse la neurohypophyse et transporte l’ocytocine vers la périphérie.
Pendant le développement embryonnaire, les neurones hypothalamiques sont issus de cellules progénitrices qui acquièrent progressivement leurs propriétés neuronales à la suite de leur exposition à des gradients de signaux moléculaires sécrétés. Ces signaux activent des programmes de transcription spécifiques qui conduisent à l’identité cellulaire de type ocytocine ou vasopressine. Pendant la différenciation du SNH, les axones en élongation traversent de longues distances pour atteindre leur cible en s’allongeant vers des signaux attractifs et en s’écartant de signaux répulsifs sécrétés tout le long du chemin.
A la différence des neurones, les vaisseaux sanguins ne sont pas nés dans le cerveau mais ils s’y étendent via l’angiogenèse, un processus par lequel de nouveaux vaisseaux se forment par bourgeonnement et extension de vaisseaux préexistants. Comme les axones, les bourgeons vasculaires poussent vers les sources de molécules trophiques sécrétées. De cette manière, le réseau capillaire de la neurohypophyse tire son origine des vaisseaux majeurs, veineux et artériels, de la tête. Il est bien connu que le passage des hormones neurohypophysaires depuis les terminaisons nerveuses jusqu’au sang est facilité par la nature perméable des capillaires fenêtrés de l’hypophyse mais le contrôle de la fenestration de ces vaisseaux n’est pas élucidé.
Trouver son chemin
Comment donc axones et vaisseaux sanguins interagissent-ils pour former la neurohypophyse fonctionnelle ? Cette question est restée largement sans réponse mais notre meilleure compréhension du guidage axonal et de la mise en place des « patrons »vasculaire peut nous aider à spéculer sur des stratégies possibles.
———————
“…l’ocytocine construit activement la matrice vasculaire nécessaire à sa propre libération vers la périphérie.”
———————
Une possibilité est qu’un signal biochimique trophique est sécrété par l’ébauche neurohypophysaire elle-même (peut-être par les pituicytes) et attire simultanément à la fois les axones des neurones hypothalamiques et les pousses vasculaires voisines. Cette hypothèse gagne du crédit par la constatation que les cônes de croissance axonaux répondent à des facteurs connus comme angiogéniques, de la même manière que des bourgeons vasculaires poussent vers des signaux identifiés de guidage axonal. Une autre possibilité est qu’un des composants attire l’autre : les vaisseaux hypophysaires naissants libèrent une molécule d’attraction pour les axones en croissance des neurones hypothalamiques ou bien les terminaisons axonales secrètent un facteur angiogénique qui attire les bourgeons vasculaires avoisinants. Une publication récente a aidé à trancher la question en démontrant que, chez les embryons de poisson-zèbre, l’ocytocine agit comme un signal angiogénique pour les bourgeons vasculaires voisins, les attirant vers les terminaisons axonales où ils parviennent pour former les artères et les veines hypophysaires (Fig 1). Cette découverte souligne clairement une hiérarchie dans la mise en place de l’interface neurohypophysaire . D’une certaine manière l’ocytocine construit activement la matrice vasculaire nécessaire à sa propre libération vers la périphérie.
Rebâtir ce qui a été détruit
La lésion des axones du tractus neurohypophysaire chez le rat entraîne la régénération des terminaisons nerveuses dans une position ectopique où se produit alors une angiogenèse accrue permettant le rétablissement d’une nouvelle neurohypophyse fonctionnelle ectopique. Etonnamment, cette prouesse de régénération a depuis été retrouvée chez des patients dont l’hypophyse avait été enlevée chirurgicalement. L’imagerie in vivo des axones en régénération et des vaisseaux sur ce modèle du poisson-zèbre devrait prochainement permettre de comprendre les mécanismes moléculaires à la base de ce remarquable processus, potentiellement riche de retombées cliniques dans le domaine de la régénération du système nerveux central.
Quo vadis
Depuis plus d’un siècle, les recherches sur l’interface neurohypophysaire nous ont fourni de nombreuses données sur la nature de la neurosécrétion et des interactions neurovasculaires. Des questions encore plus intrigantes attendent des réponses, qui pourraient venir bientôt des nouveaux et puissants outils génétiques et des méthodes d’imagerie : comment les axones des neurones à ocytocine et vasopressine trouvent-ils leur chemin jusqu’à la neurohypophyse ? Quel rôle, s’il en est un, jouent les pituicytes dans ce mécanisme de guidage axonal ? Qu’est ce qui régule la fenestration des capillaires hypophysaires et quand deviennent-ils perméables aux neuropeptides ? Sans aucun doute l’histoire de la neurohypophyse, déjà vieille de plus d’un siècle, nous promet encore quelques rebondissements…
Traduction :
André Calas, Institut Interdisciplinaire de Neurosciences CNRS- Université de Bordeaux2, France.
(avec la contribution de Gérard Alonso et Françoise Dieterlen)
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction
