Résumé
Des modifications de l’environnement fœtal ont des répercussions durant la vie entière à la fois sur les fonctions endocrines et le comportement de l’individu. Un stress maternel, via l’activation de l’axe hypothalamo-hypophyso-surrénalien (axe HHS ou corticotrope) et la production de glucocorticoïdes, peut provoquer une augmentation des niveaux d’anxiété et de la réactivité au stress chez la descendance. Qui plus est, chez l’animal, ces effets peuvent se transmettre à la génération suivante. Le challenge consiste dorénavant non seulement à identifier les mécanismes physiologiques, cellulaires et moléculaires impliqués mais aussi et surtout à découvrir des moyens thérapeutiques visant à contrecarrer les effets délétères des stress prénataux chez l’homme, soit par des stratégies préventives, ou à défaut curatives.
Retour aux origines…
L’expérience précoce (ou périnatale) influence le fonctionnement endocrinien et le comportement d’un individu sa vie durant mais aussi ceux de sa descendance. Cette association, bien que connue depuis de nombreuses années, a été depuis largement étayée par des études épidémiologiques menées chez l’homme qui ont permis d’établir un lien entre un faible poids de naissance et le risque accru de développer des pathologies chroniques comme le diabète et l’hypertension. Ces observations ont conduit au concept de ” programmation fœtale ” qui stipule qu’être bien portant ou bien de santé précaire pourrait découler directement des conditions environnementales dans lesquelles le fœtus/ nouveau-né s’est développé.
Mais pourquoi avons-nous cette capacité de ” programmer ” en quelque sorte notre descendance ? Chez l’homme, il a été suggéré qu’un petit poids de naissance constitue un indice indirect de l’état de santé du fœtus et est le reflet d’une disponibilité limitée en nutriments, soit en raison d’une alimentation maternelle inappropriée ou bien d’une altération fonctionnelle du placenta. Le fœtus, pour assurer au mieux sa survie, va adapter son développement par anticipation et considérer comme ” normal ” le milieu appauvri en nutriments dans lequel il baigne. Néanmoins, si après la naissance l’alimentation est abondante, l’individu se trouvera inadapté dans ce nouvel environnement et sera plus enclin à développer des pathologies. Pour mieux comprendre ce phénomène, prenons l’exemple d’une espèce animale en contact répété avec de multiples prédateurs. Pour garantir au mieux la survie de son espèce, la femelle gestante donnera naissance à des petits présentant un niveau d’anxiété naturellement élevé ce qui, in fine, les aidera à ne pas être tués facilement.
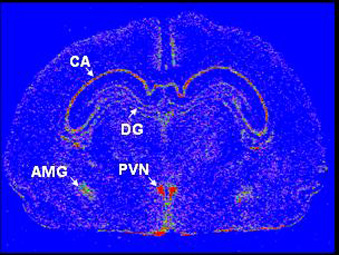
Expression du gène du récepteur aux glucocorticoïdes dans la corne d’Ammon (CA) et le gyrus denté (DG) de l’hippocampe, et dans l’amygdale (AMG) et le noyau paraventriculaire (PVN) du cerveau fœtal de cobaye.
Le stress maternel
Des études menées chez l’homme indiquent qu’une mère très anxieuse durant sa grossesse donnera plus fréquemment naissance à des enfants hyperactifs et présentant des désordres de l’attention. De tels désordres comportementaux ont été également observés à partir d’études réalisées chez l’animal, chez qui les mécanismes physiologiques ont pu être étudiés. Dans de nombreuses espèces, le stress maternel durant la gestation va conduire à l’émergence d’une descendance qui présentera des désordres comportementaux et des dysfonctionnements de l’axe corticotrope en réponse au stress.
Néanmoins les études réalisées chez l’animal présentent aussi leurs limites, principalement en raison d’une trop grande diversité des approches expérimentales réalisées par les différents laboratoires. Par exemple, la durée, la nature et l’intensité du stress ainsi que le moment de la gestation pendant lequel la mère y est soumise ou encore l’âge et le sexe des descendants que l’on étudie, sont autant de facteurs contribuant à l’hétérogénéité des résultats obtenus. Des études réalisées récemment ont montré que le moment durant lequel est appliqué le stress maternel est critique tant sur les fonctions endocrines que sur le comportement du cobaye. Des animaux mâles adultes issus de femelles exposées à un stress psychologique de faible durée (48 heures) vers le 50ème jour de gestation, dont la durée totale est d’environ 70 jours chez cette espèce, présentent une anxiété et une activité de l’axe corticotrope élevées et des taux plasmatiques de testostérone amoindris. A l’inverse, un même stress appliqué dix jours plus tard n’a pas les mêmes conséquences, et les descendants ne sont plus affectés quant à leur niveau d’anxiété, leur taux de testostérone et l’activité de leur axe HHS en conditions de base. Néanmoins, l’axe corticotrope de ces animaux présente une activité exacerbée en réponse à un stress. Il existe donc des ” fenêtres ” temporelles pendant lesquelles le cerveau en développement est plus particulièrement sensible au stress maternel ; à l’évidence de telles fenêtres existent également chez l’Homme.
——————–
” Il existe donc des ” fenêtres ” temporelles pendant lesquelles le cerveau en développement est plus particulièrement sensible au stress maternel… “
——————–
Quel est le signal maternel de programmation fœtale ?
Comment le stress et l’anxiété maternels interfèrent-ils sur le développement du fœtus ? Le stress maternel conduit à de nombreuses perturbations endocriniennes de la mère, lesquelles peuvent affecter directement le fœtus ou indirectement en modifiant l’activité placentaire. Plusieurs études très élégantes, réalisées principalement chez le rat, ont permis d’apporter de solides évidences quant au rôle capital joué par les glucocorticoïdes maternels dans la programmation de l’axe corticotrope de la descendance. Dans la plupart des espèces, les concentrations plasmatiques de glucocorticoïdes maternels sont environ 10 fois plus élevées que celles du fœtus. Bien que ces hormones soient requises pour assurer un bon développement du fœtus, leur excès peut inhiber la croissance fœtale, et donc entraîner une réduction du poids de naissance. Le fœtus est en réalité protégé d’un excès de glucocorticoïdes maternels par une enzyme inhibitrice qui est abondamment produite par le placenta. Néanmoins, bien que celle-ci constitue une barrière efficace pour réduire l’accès des glucocorticoïdes vers le fœtus, le stress de la mère, via l’activation de son axe HHS, entraîne une surexposition fœtale à ces hormones stéroïdes.
Glucocorticoïdes et accouchement prématuré
L’accouchement prématuré concerne environ 10% des grossesses, bien que ce nombre soit en augmentation. Le traitement de la mère par des glucocorticoïdes de synthèse assure efficacement la maturation des bronches du fœtus, et diminue la mortalité néonatale des bébés nés avant terme. De fait, ce traitement est utilisé très fréquemment dans la gestion des accouchements prématurés, et jusqu’à très récemment, les femmes à risque étaient traitées par des doses répétées de bétaméthasone (un glucocorticoïde de synthèse). Cependant, à la différence des hormones naturelles, les glucocorticoïdes de synthèse ne sont pas dégradés par l’enzyme placentaire et peuvent donc parvenir jusqu’au fœtus. Bien que la cible à atteindre soit pulmonaire, le cerveau du fœtus contient aussi un nombre très élevé de récepteurs aux glucocorticoïdes, et ce particulièrement dans des structures exerçant un rôle capital dans la régulation du comportement et des fonctions endocrines. S’il semble clair que les glucocorticoïdes constituent au moins en partie le signal de ” programmation ” du fœtus, sont-ils pour autant responsables des effets à long terme ?
Des études réalisées chez l’animal indiquent que des expositions uniques ou répétées du fœtus aux glucocorticoïdes sont responsables d’effets à long terme sur la fonction corticotrope, l’apprentissage et l’activité de la descendance. En réalité, la plupart des altérations observées sont assez semblables à celles qui découlent d’un stress prénatal. Chez l’Homme, les données sont beaucoup moins claires. Une étude comportementale rétrospective a établi une corrélation entre le fait d’avoir été exposé in utero au moins trois fois aux glucocorticoïdes synthétiques et l’émergence de désordres comportementaux et de signes d’hyperactivité chez l’enfant. A l’inverse, une autre étude réalisée à partir d’adultes ayant été exposés in utero à une dose unique de glucocorticoïdes synthétiques n’a rien révélé de notable si ce n’est quelques signes subtils de résistance à l’action de l’insuline. Bien que les bénéfices à court terme d’un traitement par les glucocorticoïdes de synthèse soient indéniables dans le cadre des accouchements prématurés, leurs conséquences éventuelles à long terme, en particulier en cas d’expositions multiples, ne doivent pas être négligées.
La programmation fœtale est-elle transmissible ?
Est-il possible que les expériences de notre grand-mère pendant sa grossesse puissent influencer nos fonctions endocrines et notre comportement ? Des études récentes réalisées chez l’animal tendraient à montrer que ce pourrait être effectivement le cas. Chez le rat, une exposition prénatale à des doses répétées de glucocorticoïdes de synthèse entraîne une diminution du poids de naissance à la seconde génération, celle-ci étant accompagnée d’une modification du niveau d’expression de gènes hépatiques. Chez le cobaye, une exposition répétée de glucocorticoïdes synthétiques se traduit en particulier par une diminution du taux de glucocorticoïdes plasmatiques chez la seconde génération de descendants. Ces observations amènent à se poser des questions fascinantes. Existe-t-il une mémoire inter générationnelle… et surtout comment se transmet-elle ?
Traduction :
Didier Vieau, Laboratoire de Neurosciences et Physiologie Adaptatives, Equipe stress périnataux, Université des Sciences et Technologies de Lille, France
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction.
