Résumé
La maladie de Cushing est l’une des pathologies les plus fascinantes de toute l’endocrinologie où une tumeur minuscule de l’hypophyse entraîne l’apparition de toute une panoplie de symptômes, signes cliniques et modifications de l’humeur et du comportement. Des travaux récents ont commencé à identifier les évènements moléculaires impliqués dans la sensibilité réduite des cellules tumorales hypophysaires aux mécanismes physiologiques de régulation et de contrôle du cycle cellulaire. Ils pourraient conduire in fine à la mise au point de thérapies géniques spécifiques
Le syndrome de Cushing
Il y a peu de situations en endocrinologie clinique plus spectaculaires que les transformations frappantes de l’apparence physique et du comportement associées au syndrome de Cushing. Le tronc prend un aspect empâté et la graisse s’accumule dans l’abdomen alors que les muscles des bras et des cuisses s’amincissent. Cette entité pathologique, décrite pour la première fois à Boston en 1932 par le neurochirurgien Harvey Cushing, est en fait la conséquence d’une exposition excessive des différents tissus de l’organisme à une famille d’hormones stéroïdes, les glucocorticoïdes. Ces hormones, en particulier le cortisol, ont été initialement décrites en tant que produit de sécrétion de la glande surrénale. Pendant les années 1950, la mise en évidence de leur puissante action anti-inflammatoire les a rapidement propulsées au rang d’agents thérapeutiques incontournables dans la prise en charge de maladies aussi différentes que la polyarthrite rhumatoïde et l’asthme. Même aujourd’hui, la forme la plus fréquente de syndrome de Cushing est celle qui résulte d’un traitement par des doses supra-physiologiques de glucocorticoïdes de synthèse, qu’elles soient administrées par voie orale, en spray pour la prise en charge de l’asthme, ou même sous forme de pommades prescrites pour diverses affections dermatologiques.
La maladie de Cushing
La cause la plus fréquente de syndrome de Cushing chez un sujet qui ne prend aucun traitement est la maladie de Cushing, affection qui résulte d’une tumeur de la glande hypophyse. L’hypophyse est localisée dans la boîte crânienne, en dessous du cerveau et en arrière des globes oculaires. Malgré son faible volume, elle joue un rôle physiologique majeur en contrôlant l’activité des glandes endocrines périphériques. Au cours de la maladie de Cushing, une tumeur de petite taille développée aux dépens de l’hypophyse secrète des quantités excessives d’hormone adrénocorticotrophique (ou corticotrophine, ACTH) qui viennent sur-stimuler les glandes surrénales, ce qui entraîne ensuite une augmentation de la taille de ces dernières et une sécrétion exagérée de cortisol. Le rythme journalier normal de la sécrétion de cortisol, qui génère des taux sanguins élevés de cortisol à 8 heures du matin et des taux très bas entre minuit et 2 heures du matin, est totalement perturbé. Cette perturbation du rythme sécrétoire du cortisol est d’ailleurs l’un des signes distinctifs de la maladie de Cushing. En outre, l’action freinatrice des glucocorticoïdes sur la sécrétion d’ACTH (rétrocontrôle) est réduite, ce qui constitue une autre caractéristique de la maladie utilisée à des fins diagnostiques.
———————-
“Ces tumeurs sont presque toujours de type monoclonal….”
———————-
La maladie de Cushing enfin expliquée ?
En raison des modifications physiques spectaculaires qu’elle entraîne, la maladie de Cushing est souvent dépistée alors que la tumeur qui en est responsable n’atteint que quelques millimètres de diamètre. Ces tumeurs sont presque toujours de type monoclonal, ce qui signifie qu’elles résultent de la prolifération incontrôlée d’une seule cellule anormale. L’évènement moléculaire initial peut être une modification génétique ou une mutation qui augmente la capacité de synthèse d’ACTH d’une cellule unique par rapport aux cellules voisines. Avec le temps, les taux élevés de cortisol, qui vont freiner les autres cellules sécrétrices d’ACTH (encore appelées cellules corticotropes), permettent à la cellule mutée d’acquérir sélectivement un avantage en terme de croissance, ce qui favorise l’expansion monoclonale. La mise au repos, voire l’atrophie des cellules environnantes avait d’ailleurs été remarquée par les anatomopathologistes depuis de nombreuses années. A l’inverse des tumeurs à potentiel malin, qui résultent habituellement de l’apparition de mutations successives, la petite taille des tumeurs hypophysaires caractéristiques de la maladie de Cushing suggère qu’une ou deux anomalies moléculaires au plus sont venues affecter la machinerie de contrôle du cycle cellulaire. Un travail récent a commencé à préciser la nature de ces anomalies intracellulaires. Une première approche a consisté à étudier le rétrocontrôle normal des cellules corticotropes par les glucocorticoïdes et a déjà permis de formuler des hypothèses pertinentes sur les mécanismes impliqués dans la diminution de la sensibilité des cellules corticotropes au cortisol circulant. Dans quelques observations, la concentration de récepteurs du cortisol présents dans les cellules corticotropes serait anormalement réduite, ou le récepteur serait muté, ce qui entraînerait une diminution de sa capacité à freiner efficacement la sécrétion d’ACTH. Plus récemment, d’autres études ont montré qu’une enzyme, dont le rôle est d’inactiver le cortisol, pourrait être présente en quantité excessive dans les cellules hypophysaires. Une telle observation signifierait que les cellules corticotropes tumorales détecteraient moins de cortisol dans leur milieu environnant et sécréteraient, de ce fait, des quantités inappropriées d’ACTH.
Par ailleurs, des gènes habituellement impliqués dans la régulation de la division cellulaire (gènes suppresseurs de tumeur ou GST) pourraient être inactivés. Un groupe a déjà montré que le GST connu sous le nom de p16 peut être neutralisé par un processus biochimique appelé méthylation. Dans d’autres études, un GST appelé p27 produit une protéine qui est sous exprimée et rapidement métabolisée dans les tumeurs sécrétrices d’ACTH. Un gène distinct des GST, déjà connu comme oncogène, pourrait éliminer sélectivement p27 des noyaux cellulaires et permettre ainsi sa dégradation par un mécanisme “éboueur”. L’ensemble de ces travaux suggère que nous sommes maintenant très proches de l’identification exhaustive des causes moléculaires de la maladie de Cushing.
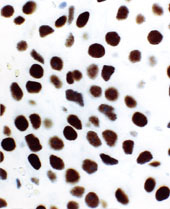
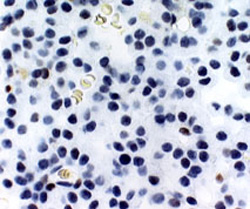
Aspect microscopique des tumeurs hypophysaires sécrétant de l’hormone de croissance (photographie de gauche) ou de l’ACTH (photographie de droite) marquées par un anticorps dirigé contre la protéine dérivée du gène suppresseur de tumeur p27 localisée dans le noyau cellulaire. La tumeur sécrétrice d’hormone de croissance contient des quantités détectables de protéines p27 dans le noyau cellulaire (coloration marron). Dans les tumeurs sécrétrices d’ACTH, seule la contre coloration bleue est visible dans les noyaux des cellules.
———————-
“Ces travaux suggère que nous sommes maintenant proches de l’identification des causes de la maladie de Cushing”
———————-
Ces travaux sont-il réellement importants ?
Alors que la maladie de Cushing est rare, avec tout au plus un nouveau cas par an pour 250 000 personnes, les glucocorticoïdes sont susceptibles d’entraîner des maladies de façon beaucoup plus subtile. Le lien supposé et souvent mentionné entre le stress et les maladies pourrait être relayé en majeure partie par le cortisol, ce qui permettrait notamment d’expliquer la corrélation inverse entre le niveau social et la mortalité. Il a également été suggéré que le stress intra-utérin ou néonatal peut déterminer à long terme la réactivité de la sécrétion de cortisol au stress, qui pourrait ensuite être impliquée dans des pathologies courantes de l’âge adulte. L’obésité, l’hypertension et l’hyperlipidémie, dont l’incidence augmente régulièrement dans les pays développés, pourraient ainsi résulter d’une sécrétion de glucocorticoïdes trop tonique analogue à celle observée au cours de la maladie de Cushing. Une meilleure compréhension de la physiopathologie des rares tumeurs hypophysaires responsables de la maladie de Cushing devrait donc améliorer notre vision globale de l’impact du stress sur l’espérance de vie.
Traduction :
Hervé Lefebvre, INSERM U413, Rouen
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction.
