Résumé
La pathogénèse de la majorité des adénomes hypophysaires n’est toujours pas comprise, de même que le caractère en général bénin de ces tumeurs. La compréhension de l’activité ” trophique “(1) de l’hypophyse normale peut être la clé de ce problème. En dépit du fait que les variations des index mitotique et de mort cellulaire programmée, qui sont trop faibles pour être mesurés, peuvent produire des flux significatifs des populations cellulaires, les patrons de réponse des cellules hypophysaires aux stimuli hormonaux sont maintenant progressivement révélés.
“Normalité exubérante”
Les tumeurs hypophysaires affectent plus de 10% d’entre nous au cours de notre vie. Seule une très petite proportion d’entre elles est décelée par l’examen clinique, soit par hypopituitarisme, soit par hypersécrétion, soit par compression des structures environnantes tel que le chiasma optique. En outre, lorsqu’elles sont présentes, leur comportement est remarquablement bénin : 50% d’entre elles ne dépassent pas le diamètre de 1cm et, dans leur majorité, les plus volumineuses croissent très lentement ou pas du tout. Une proportion significative des microprolactinomes disparaît spontanément. Les macroprolactinomes régressent quelque fois spontanément et ne montrent aucun signe de retour, même après l’arrêt d’un traitement à long terme avec un agoniste dopaminergique. Certains adénomes corticotropes ont la capacité bizarre de présenter des cycles répétés de sécrétion normale et anormale. De nombreux adénomes hypophysaires retiennent la capacité de répondre à des signaux hormonaux physiologiques et l’extension métastatique est très rare. La recherche de l’implication dans la formation des adénomes d’oncogènes classiques ou de gènes suppresseurs de tumeur a été presque entièrement infructueuse et, bien que l’on attribue aux tumeurs hypophysaires les propriétés de “vraies” tumeurs, telles que aneuploïdie et origine clonale, la signification maligne de ces critères est, dans l’ensemble, assez peu convaincante.
La plupart des chercheurs dans ce domaine sont persuadés que les dysfonctions hypothalamiques sont rarement impliquées dans l’induction des tumeurs hypophysaires. Cependant la possibilité que le microenvironnement ait un effet significatif sur le comportement et la propagation de ces adénomes est de nouveau difficile à rejeter. Etant donné que les caractéristiques des adénomes hypophysaires consistent en une ” normalité exubérante ” plutôt que dans une malignité bénigne, le contrôle des mitoses et des apoptoses dans l’hypophyse normale en réponse à des signaux hormonaux est de nouveau l’objet d’examens rigoureux.
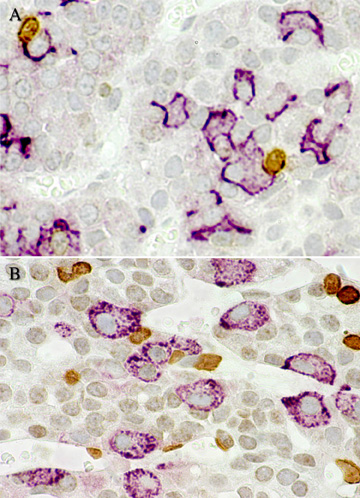
Double localisation immunocytochimique du BrdU (un marqueur du cycle cellulaire) et de l’ACTH (A) ou de l’hormone lutéinisante LH (B), dans l’hypophyse antérieure de rats surrénalectomisés et castrés puis sacrifiés quatre jours après, c’est-à-dire au pic de la réponse mitotique. On constate que les cellules immunopositives pour chacune des deux hormones d’une part et pour le BrdU d’autre part sont nombreuses. Par contre les cellules exprimant simultanément BrdU et une hormone sont absentes sur ces images (courtoisie de Lesley A Nolan).Remarque du traducteur : on note sur ces beaux clichés, en A l’accolement de deux cellules à ACTH avec, chacune, une cellule BrdU- positive et, en B, l’accolement d’une ou deux cellules à LH avec, chacune, une cellule BrdU-positive. En B , dans l’angle supérieur droit, une cellule doublement marquée ?
Comment l’hypophyse normale contrôle-t-elle les populations respectives des différents types cellulaires qu’elle contient ? Pendant des années on a estimé que dans des conditions constantes aucun événement ” trophique ” n’intervient dans l’hypophyse adulte. On admettait que la stimulation hormonale, par exemple la surrénalectomie bilatérale, induisait la division des cellules corticotropes afin d’assurer l’augmentation de la sécrétion de l’ACTH en réponse aux effets ” trophiques ” de l’accroissement du CRH provenant de l’hypothalamus. Effectivement, malgré les limites de l’immunocytochimie quantitative, des changements dramatiques des proportions des cellules corticotropes sont incontestablement observés dans ces conditions. De plus, un examen attentif et soutenu permettait de capter occasionellement des cellules corticotropes en voie de division et l’infusion de doses élevées de CRH, pour une durée prolongée, était accompagnée d’une augmentation des divisions cellulaires dans l’hypophyse. Cependant dans ces expériences le nombre des cellules immunocytochimiquement identifiables en division est trop faible pour expliquer le changement rapide de la proportion de cette population cellulaire. De nouvelles données sont actuellement recueillies qui, bien qu’encore incomplètes, forment progressivement un ensemble cohérent.
Cellules oligopotentes
Un à deux pour cent des cellules hypophysaires sont des cellules oligopotentes qui ont une activité mitotique continue à un taux sensiblement constant qui décroît avec l’âge. Le renouvellement de ces cellules présente des variations diurnes subtiles et est temporellement inhibé par des niveaux pharmacologiques de glucocorticoïdes. L’activité mitotique de base due à ce pool de cellules souches oligopotentes est semble-t-il suffisante pour assurer le renouvellement complet des cellules hypophysaires toute les 5 semaines environ, en admettant qu’elles survivent toutes. En fait, en absence de changement de l’environnement physiologique ou psychologique (stress) la plupart d’entre elles ne survivent pas. Celles d’entre elles, en petit nombre, qui échappent à l’apoptose persistent en tant que cellules progénitrices, exprimant des récepteurs mais pas d’hormone hypophysaire (cellules “nulles”). Ces cellules progénitrices sont capables d’effectuer plusieurs cycles de divisions si, et seulement si, les conditions endocrines changent. Les changements hormonaux soudains plutôt que persistants semblent la clé de l’induction de cette activité “trophique “.
———————-
…”l’activité mitotique limitée des cellules filles des cellules souches oligopotentes est inhibée “…
———————-
Il apparaît alors que l’activité mitotique limitée des cellules filles des cellules souches oligopotentes est inhibée toniquement par la corticostérone et la testostérone, et stimulée par les estrogènes et les hormones thyroïdiennes. Une réduction soudaine de la testostérone induit une onde auto-limitée de mitoses, donnant naissance à des cellules filles “nulles”. Il en est de même après castration . Le retrait simultané de la corticostérone et de la testostérone produit une onde d’augmentation de l’activité mitotique qui n’est pas supérieure à celle induite par une seule de ces hormones. Il semble donc qu’une seule et même population cellulaire répond à chacune de ces hormones. Cependant, si cette activité mitotique frénétique mais auto-limitée donne naissance à des cellules “nulles”, comment expliquer que le nombre de cellules immunopositives change rapidement ? Ce ne sont certainement pas les cellules nouvellement formées qui se différencient. Il apparaît plutôt que des cellules “nulles”,formées 2 à 3 semaines plus tôt, sont indépendamment stimulées sous l’action du même changement hormonal et se différencient simultanément en cellule sécrétrices d’hormone. La division de cellules différenciées pré-existantes n’intervient que pour moins de 5% dans l’accroissement consécutif au changement hormonal, et donc loin de la part du lion représentée par les nouvelles cellules immunopositives apparues en réponse au changement hormonal.
Cependant, les plus dramatiques changements physiologiques de la structure et la fonction de l’hypophyse interviennent pendant la gestation et malgré l’importance de cette question, on ne comprend pas encore bien comment les changements considérables, dans les proportions relatives des cellules à prolactine et des cellules à hormone de croissance, sont établis puis régressent après la mise bas. Il en est de même pour l’exposition continue aux estrogènes, qui, outre des changements aigus, peuvent exercer des effets plus subtils mais persistants pendant des semaines et des mois.
Tenant compte de l’ensemble de ces données, on peut suggérer que des systèmes spécifiques co-régulateurs reliant la machinerie moléculaire de la mitose avec celle de l’apoptose pourraient être impliqués dans l’induction des tumeurs hypophysaires et que l’épiphanie dans notre compréhension des adénomes hypophysaires est encore à venir.
———————-
(1) : ceci est la traduction littérale du mot anglais ” trophic ” qui est pris ici dans un sens général, couvrant à la fois deux aspects morphologiques de la stimulation hormonale, hypertrophie et hyperplasie (augmentation du volume et du nombre des cellules hormonales).
******************
Commentaires de A.Tixier-Vidal ajouté à la version française :
L’hypothèse de l’existence de cellules souches dans l’antéhypophyse a été suggérée de longue date au vu de la présence dans le tissu adénohypohysaire d’une proportion plus ou moins importante de cellules morphologiquement “indifférenciées “, c’est-à-dire dépourvues d’affinité tinctoriale ou histochimique. “Il n’est pas possible de dire si ces cellules sont équivalentes et fonctionnellement indéterminées ou si parmi elles existent des contingents dont l’aiguillage vers un type donné est déjà réalisé, quoique inapparent “. (J.Racadot, 1963, in ” Cytologie de l’Adénohypophyse “, colloque du CNRS). La réponse à ces questions pertinentes de Jean Racadot n’a pu être abordée expérimentalement que presque quarante ans plus tard, grâce au progrès des connaissances sur l’existence et les propriétés des cellules souches dans de nombreux tissus, ainsi que grâce aux progrès des techniques de biologie cellulaire et de biologie moléculaire.
Dans ce “Briefing” Andy Levy donne une réponse très positive. Cependant des conclusions plus nuancées sur l’identification et la fonction des cellules souches dans l’adénohypophyse murine sont apparues dans la littérature de ces dix dernières années. Il m’a paru intéressant de résumer brièvement les trois approches expérimentales mises en œuvre parallèlement par des groupes distincts.
1-L’analyse morphométrique assistée par ordinateur permettant de quantifier la prévalence de figures mitotiques et de figures apoptotiques dans l’antéhypophyse du rat en fonction des conditions hormonales.
Cette approche a été initiée en 1998 par L.A. Nolan dans le groupe de A. Levy à Bristol pour l’hypophyse de rats surrénalectomisés et traités à la dexamethasone. Elle a le mérite de respecter l’intégrité du tissu adénohypophysaire. Elle a été appliquée depuis cette date a une grande variété de conditions expérimentales modifiant l’activité hypophysaire.[Ref.: Nolan, L.A., et al, J. of Neuroendocrinology, 1998, 10, 207-215; pour la suite voir Nolan et al., PubMed]
2-La mise en œuvre de techniques de clonage cellulaire (dilutions à basse ou très basse densité) sur des cellules normales dissociées à partir d’antéhypophyses de souris adultes femelles.
Cette approche a mis en évidence une population cellulaire douée d’activité clonogénique (Pituitary Colony Forming Cells, PCFCs) qui représente O,2% de la population cellulaire totale. Les PCFCs possèdent, comme les cellules folliculo-stellaires la propriété de capture du dipeptide fluorescent AMPCA, ce qui permet de les enrichir par FACS. Elles expriment un antigène de surface des cellules souches (Sca-1). Elles seraient progénitrices de la lignée GH-PRL. [Ref.: Lepore, D.A. et al. , Exp. Cell Res., 2005, 308, 166-176 ; Stem Cells, 2006, 24, 2382-90 ; Stem Cells, 2007, 25, 1730-6.]
3- La mise en oeuvre de techniques spécifiques d’isolement et de caractérisation de cellules souches établies précédemment pour une variété de tissus , notamment le tissus hématopoïétique.
Cette approche a permis l’isolement par FACS, au sein de la population totale de cellules dissociées d’hypophyse de souris adulte, d’une sous-population excluant le colorant vital Hoescht 33342. Cette “side population” (SD) représente 1,7% de la population totale. Ces cellules sont de tailles petite à moyenne, peu “granulaires”. Elles expriment plusieurs gènes associés au phénotype des cellules souches ou progénétrices dans d’autres tissus (antigène Sca-1, nestin, molécules des voies de signalisation Notch, Wnt, Shh), ainsi que des facteurs de transcription de la différentiation précoce des cellules hypophysaires . Elles n’expriment aucun des ARNm d’hormones antéhypophysaires mais contiennent une petite proportion de cellules folliculo-stellaires (AMPCA+).
Leur activité clonogénique est appréciée par la technique de culture en suspension de microsphères ; environ 0,02% des cellules antéhypophysaires possédent la capacité d’expansion clonale. Cependant le caractère pluripotent ou oligopent de ces cellules n’est pas encore démontré. Les auteurs n’excluent pas l’hypothèse que les cellules SD proviennent de la dédifférentiation de cellules glandulaires, ce qui impliquerait une transdifférenciation (et le retour à l’hypothèse ancienne du cycle des cellules hypophysaires autrefois émise par Romeis, 1940, ??) [.Ref.: Chen, J. et al., Endocrinology, 2005, 146, 3985-98 ; Krylyshkina, O., et al., Endocrinology, 2005, 146, 2376-87.]
Hugo Vankelecom a récemment publié deux revues critiques sur l’état actuel des connaissance sur les cellules souches hypophysaires:
* “Non-hormonal cell types in the pituitary candidating for stem cells” in Seminars in Cell & Developmental Biology, 2007, 18, 559-570.
* “Stem cells in the postnatal pituitary” Neuroendocrinology, 2007, 95, 110-130.
L’auteur conclut qu’aucun des types cellulaires candidats au rôle de cellules souche proposés jusqu’ici ne remplit tous les caractères essentiels de cellule souche…
Traduction :
Andrée Tixier-Vidal, Dr Sc., Directeur de Recherche Honoraire au C.N.R.S.
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction.
